Mikroskopiplattform
Hos oss på Biologiska institutionen möter du personal med lång erfarenhet av att jobba med mikroskopi av biologiskt material. Vi hjälper dig genom processen eller lär dig att göra den själv.
Här kan du använda både standardtekniker, som svepelektronmikroskopi (SEM), transmissionselektronmikroskopi (TEM) och konfokalmikroskopi (CLSM), men även olika analys- och avbildningsmetoder baserade infrarött ljus och mikroröntgentomografi (mikro-CT).
Förutom möjligheten till att mikroskopera och analysera här på plats så har vi erfarenhet av att preparera prover för vidare studier med synkrotronmetoder på MAX IV eller för andra anläggningar och tekniker.
Utöver att arbeta med däggdjursvävnad har vi också erfarenhet av många andra biologiska preparat såsom insekter, växter, fossiler inklusive dinosaurier och tarm från vattenloppor. Vi har även erfarenhet av icke-biologiska material som stenar, byggmaterial, nanopartiklar och datachip.
Kontakta oss alltid innan du tar fram dina prover så att du inte förlorar dyrbart material och tid.
Du som är forskare på ett universitet eller kommer från industrin är välkommen att använda våra tjänster.
Design av experiment och utbildning
Om du behöver hjälp med provberedning och experimentell design hjälper vi till. Du kan också lära dig hur du använder vår utrustning på egen hand. Efter en utbildningsperiod tar du "körkort" och får boka och använda instrumenten själv.
Kurser i mikroskopitekniker
Vi erbjuder kurserna Microscopy Methods in Biological Research (extern webbplats) och Mikroskopi – Bio-Imaging (extern webbplats) för doktorander och masterstudenter.
Avgifter för att använda mikroskop, design av experiment och utbildning
Vi har olika avgifter för de olika typerna av mikroskop. Avgifterna beror på om du är en intern eller extern användare. Biologiska institutionen bidrar med 33% av användaravgiften för dem som använder medel administrerade av Biologiska institutionen för att täcka denna kostnad.
Konfokalmikroskopi Leica SP8
400 kr per timme
Light sheet mikroskopi Leica DLS SP8
400 kr per timme
Mikroröntgentomografi (mikro-CT) Nikon XTH 225
600 kr per timme
Svepelekronmikroskopi Hitachi SU3500
400 kr per timme
Transmissionelektronmikroskopi JEOL 1400 Plus
600 kr per timme
Support vid bildtagning och provpreparering
600 kr per timme
Provpreparation och labbsupport
Fixering och inbättning i epoxy TEM (max 10 prov)
1000 kr
Ultratunnsnittning och kontrastering för TEM
600 kr per timme
Full provpreparering för SEM, inklusive torkning och guldbeläggning (sputter coating) (max 6 prover)
1000 kr
Provpreparering för SEM, enbart montering och guldbeläggning (max 6 prov)
600 kr
Konfokalmikroskopi Leica SP8
400 kr per timme
Light sheet mikroskopi Leica DLS SP8
400 kr per timme
Mikroröntgentomografi (mikro-CT) Nikon XTH 225
800 kr per timme
Svepelekronmikroskopi Hitachi SU3500
700 kr per timme
Transmissionelektronmikroskopi JEOL 1400 Plus
800 kr per timme
Support vid bildtagning och provpreparering
750 kr per timme
Provpreparation och labbsupport
Fixering och inbättning i epoxy TEM (max 10 prov)
1600 kr
Ultratunnsnittning och kontrastering för TEM
900 kr per timme
Full provpreparering för SEM, inklusive torkning och guldbeläggning (sputter coating) (max 6 prover)
1500 kr
Provpreparering för SEM, enbart montering och guldbeläggning (max 6 prov)
800 kr
Konfokalmikroskopi Leica SP8
1200 kr per timme
Light sheet mikroskopi Leica DLS SP8
1200 kr per timme
Mikroröntgentomografi (mikro-CT) Nikon XTH 225
2500 kr per timme
Svepelekronmikroskopi Hitachi SU3500
1400 kr per timme
Transmissionelektronmikroskopi JEOL 1400 Plus
1500 kr per timme
Support vid bildtagning och provpreparering
1400 kr per timme
Provpreparation och labbsupport
Fixering och inbättning i epoxy TEM (max 10 prov)
2400 kr
Ultratunnsnittning och kontrastering för TEM
1400 kr per timme
Full provpreparering för SEM, inklusive torkning och guldbeläggning (sputter coating) (max 6 provx)
2200 kr
Provpreparering för SEM, enbart montering och guldbeläggning (max 6 prov)
1200 kr
Våra mikroskop
På mikroskopiplattformen finns följande mikroskop:
- Konfokalmikroskopi och light sheet mikroskopi för fluorescensstudier med hög upplösning.
- Infraröd-spektroskopi för att identifiera molekyler och interaktioner mellan dessa i prover med en upplösning som sträcker sig från cirka 250 μm ner till 500 nm.
- Mikroröntgentomografi (mikro-CT), för icke destruktiv avbildning av både stora (flera decimeter) och små (millimeter) föremål, med en upplösning under 2 mikron för de minsta proverna.
- Svepelektronmikroskopi (SEM) för ytavbildning i millimeter till nanometerskala.
- Transmissionselektronmikroskopi (TEM) för högupplöst subcellulär avbildning.
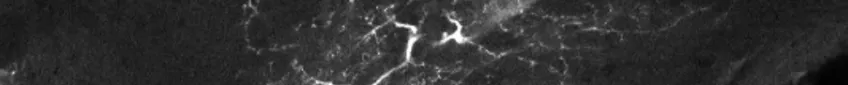
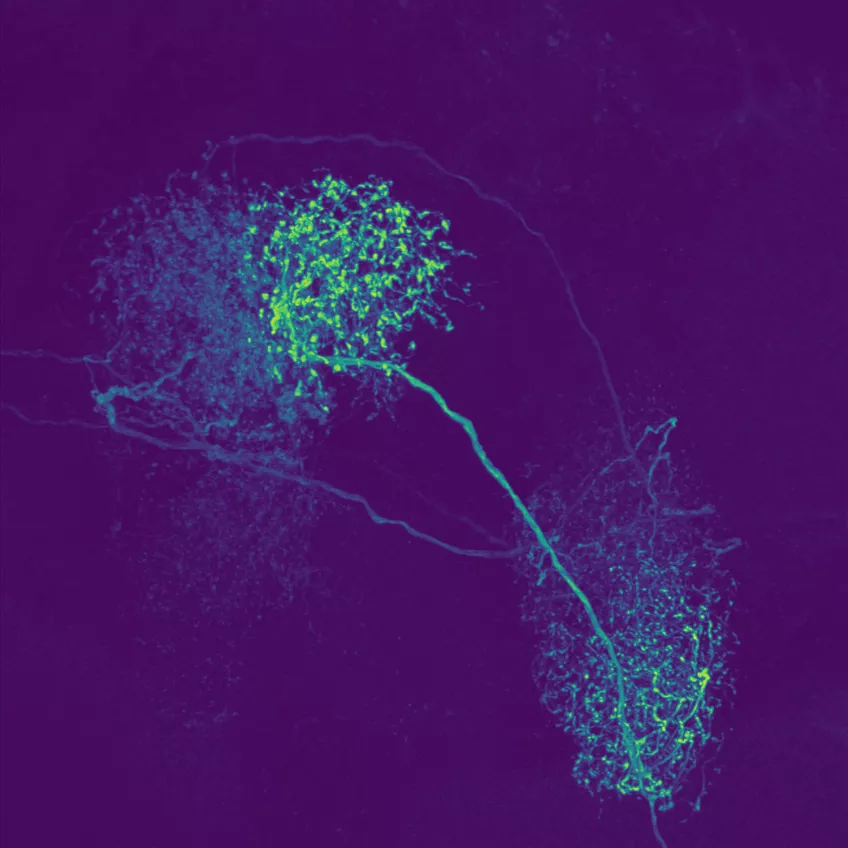
Konfokalmikroskopi
Konfokalmikroskopi
Konfokalmikroskopi är en metod för att undersöka fluorescerande eller reflekterande prover. Metoden tar bort ljus som inte är i fokus för att skapa, väldefinierade bilder av strukturer i fokalplanet. Tekniken går även att använda på prover som är för tjocka för traditionell fluorescensmikroskopi.
Genom att ta en sekvens av bilder på olika djup i ett tjockt prov kan du visualisera och rendera dem i 3D. Det gör att du kan se strukturer du inte kan se i ett traditionellt ljusmikroskop.
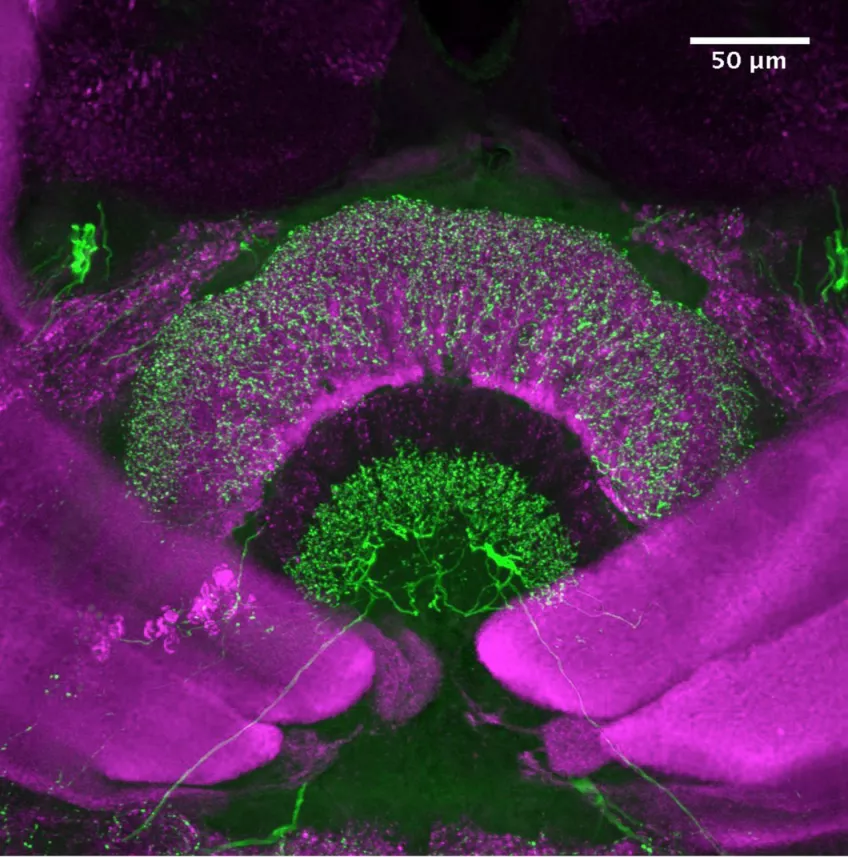
Light-sheet mikroskopi
Vårt konfokalmikroskop är utrustat med en light sheet modul. Det är är ett skonsamt sätt att avbilda känsliga prover eller snabba biologiska processer in vivo. Mikroskopet belyser provet i endast ett plan åt gången och en kamera samlar in bilder för varje belyst plan. Eftersom det inte finns någon ofokuserad stimulering minskar de fototoxiska effekterna. Genom att flytta provet genom det belysta planet kan du samla in 3D-information av ett prov. Den här tekniken avbildar stora 3D-volymer med mycket högre hastigheter och något lägre upplösning än konfokal avbildning.
Detaljer om vårt konfokalmikroskop
Vårt Leica SP8 DLS (inverterat mikroskop) är utrustat med:
- Ljuskälla: fem lasrar med våglängder på:
- 405 nm
- 488 nm
- 514 nm
- 552 nm
- 638 nm
- Detektorer: två PMT:s (fotomultiplikatorrör), en HyD GaAsP-spektral detektor, en PMT för genomsläppt ljus
- Objektiv för konfokalmikroskopi: 10x/0,3, 20x/0,75 IMM, 25x/0,95W, 63x/1,4 olja, 63x/1,3 GLYC
- Objektiv och speglar för light-sheet mikroskopi: bildbehandling 25x/0,95W DLS, 10x/0,3W DLS, belysning 2,5x/0,07, 5x/0,15, DLS TwinFlect 2,5mm, DLS TwinFlect 5mm, DLS TwinFlect 7.8mm
- Programvara: LAS X med HyVolution, Dye Finder, 3D-visualisering, Microlab (för FRAP, FLIP och FRET) och Huygens Base Package for Deconvolution.
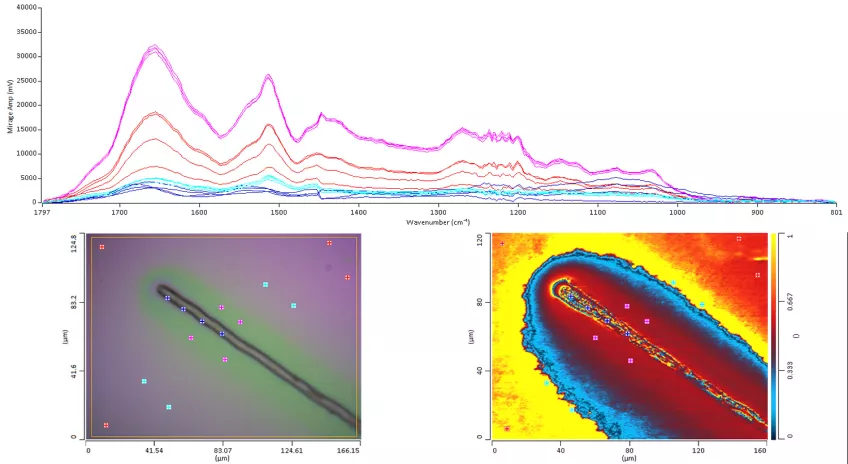
Infraröd spectroskopi
Med infraröd spektroskopi kan du studera samspelet mellan infrarött ljus och molekyler och samla in data för absorptions-, emissions- och reflektionsanalyser. Inom biologi använder vi infraröd spektroskopi för att undersöka biomolekylers specifika molekylära vibrationer. Det ger oss möjligheter att titta på olika biologiska prover såsom till exempel celler, vävnader och organ.
Infraröd spektroskopi är icke-invasiv och du märker inte in några strukturer. Du får alltså ut spektra för specifika strukturer i celler och vävnader. Det gör att du kan använda infraröd spektroskopi i både kvalitativa och kvantitativa analyser. Det är ett kraftfullt sätt att upptäcka, klassificera och förstå komplexa biologiska system.
Skillnaden mellan infraröd spektroskopi och Ramanspektroskopi är att infraröd spektroskopi mäter de absoluta frekvenser vid vilka ett prov absorberar strålning, medan Ramanspektroskopi mäter de relativa frekvenserna istället.
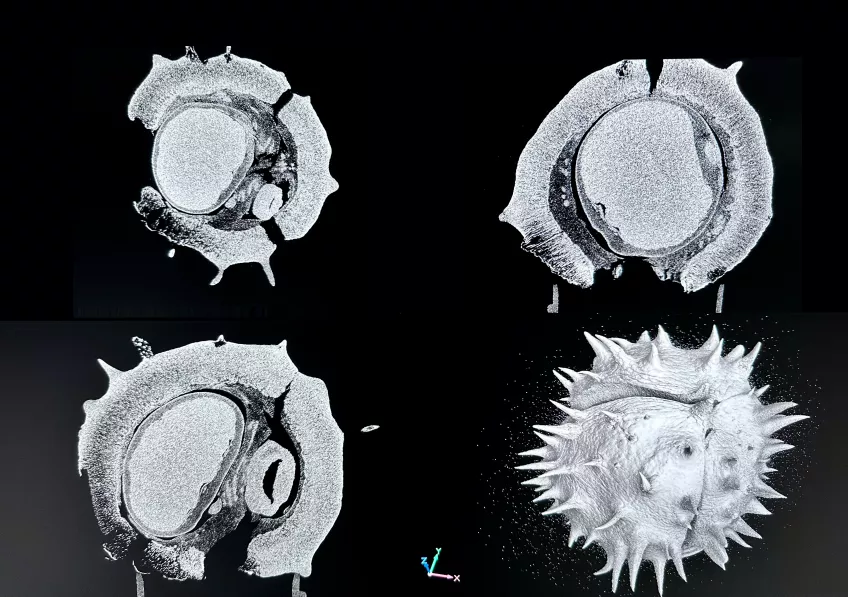
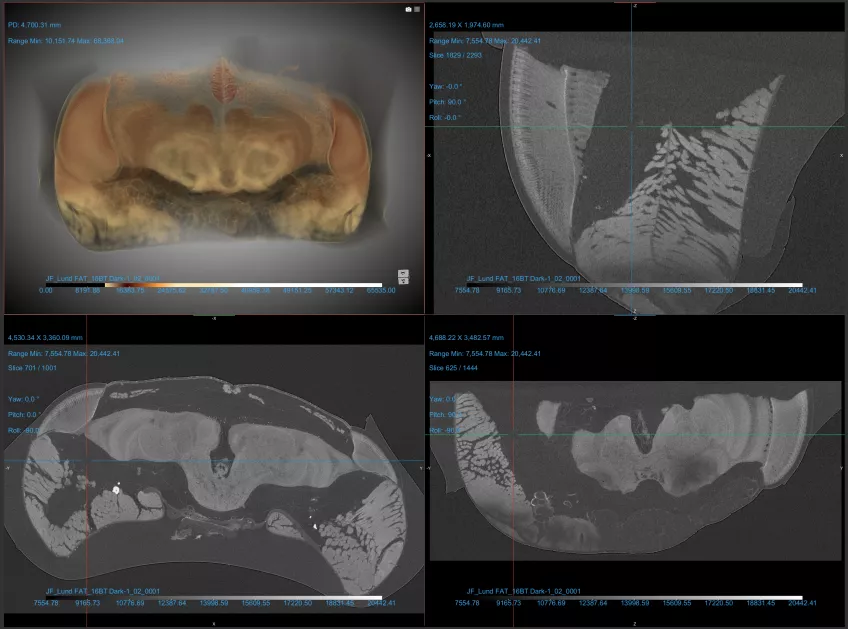
Mikroröntgentomografi (mikro-CT)
Mikroröntgentomografi (mikro-CT) är en icke-invasiv avbildningsmetod som används inom vetenskapliga och industriella områden för att detaljerat visualisera ett objekts yttre och inre struktur i 3D. Inom biologi kan vi använda mikro-CT för att undersöka biologiska prover utan att behöva dissekera dem.
Med hjälp av mikro-CT kan vi lära oss mer om hur små organismer, fossiler och biologiska vävnader ser ut och fungerar. Det finns många användningsområden för mikro-CT, till exempel inom anatomi, paleontologi, evolutionär biologi, växtbiologi geologi och materialprover från olika maskiner och datorer.
Detaljer om vårt mikrodatortomografimikroskop
Vårt mikro-CTmikroskop, ett Nikon XT H 225, är utrustat med både så kallade transmissionstarget och reflektionstarget.
När utrusningen är konfigurerad med transmissionstarget är det optimerat för mindre prover (1 cm eller mindre) och för högre upplösning. Med detta target kan du arbeta vid maximalt 180kV för att nå voxelstorlekar ner till 2 mikron.
Reflektionstarget används för större prover (upp till cirka 25 cm). Här kan du arbeta vid 225 kV och nå voxlar från 3–125 mikron beredde på provets storlek. För att nå olika röntgenspektra kan du välja olika material, volfram, molybden, silver och koppar för reflektionstarget.
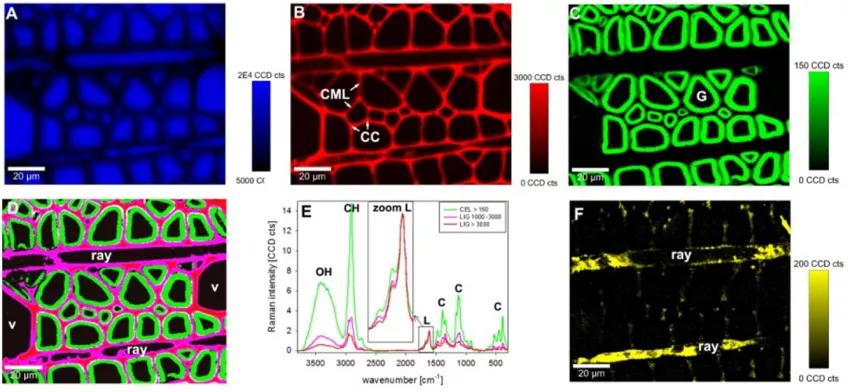
Ramanspektorskopi
Ramanspektroskopi använder spritt ljus för att mäta vibrationsenergilägena för ett prov. På så sett får du en unik kemisk och strukturell information som du kan använda för att identifiera olika ämnen.
Inom biologi kan du använda den här icke-invasiva tekniken för att känna igen olika material. Ramenspektroskopi har en upplösning på 0,5–1 µm. Med Ramenspektroskopi kan du undersöka struktur, funktion och dynamik hos olika molekyler som till exempel proteiner och nukleinsyror. Tekniken har en hög kemisk specificitet.
Skillnaden mellan Raman-spektroskopi och infraröd spektroskopi är att Raman-spektroskopi mäter de relativa frekvenserna vid vilka ett prov absorberar strålning, medan infraröd spektroskopi mäter de absoluta frekvenser istället.
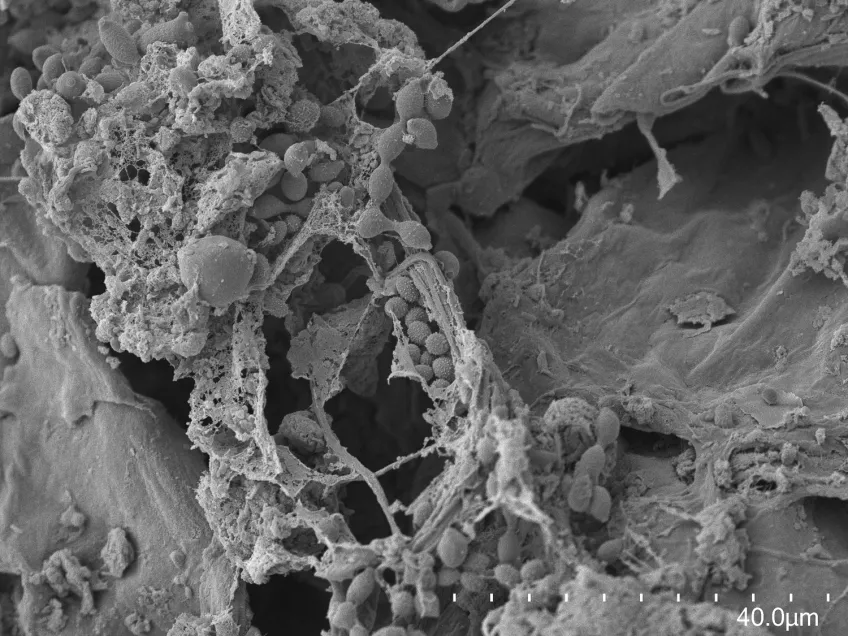
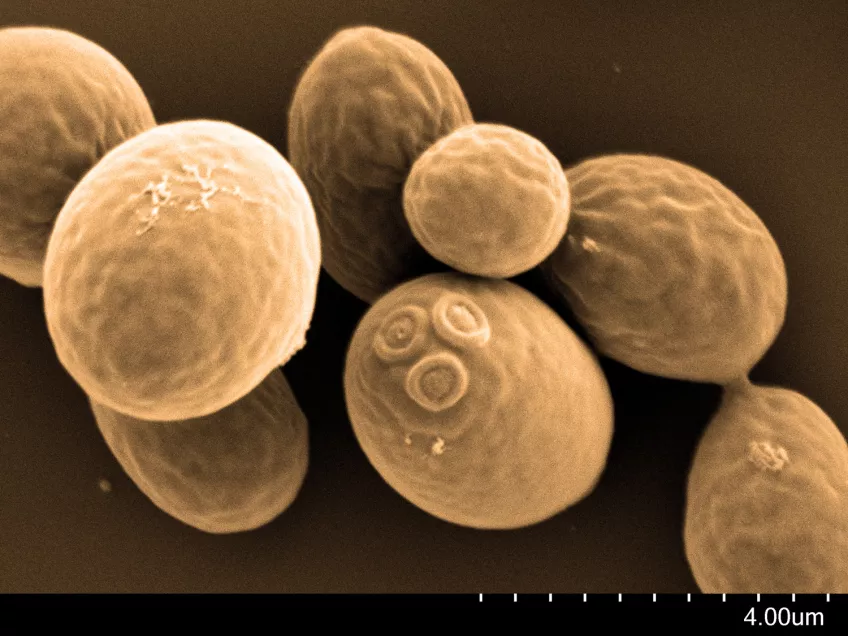
Svepelektronmikroskopi (SEM)
Svepelektronmikroskopi (SEM) används inom olika vetenskapliga och industriella områden. Med ett svepelektronmikroskop kan du studera provytor med hög upplösning. Forskare och ingenjörer använder svepelektronmikroskop för att undersöka texturen och formen på olika material.
Biologer kan ta hjälp av svepelektronmikroskop för att titta på samspel mellan celler och deras omgivning. Med hjälp av ett svepelektronmikroskop kan du studera små strukturer som hår, pollen och mikroorganismer.
Detaljer om vårt svepelektronmikroskop
Med vårt svepelektronmikroskop, ett Hitachi SU 3500, kan du utföra både hög- och lågvakuumstudier. Du kan titta på alla typer av exponerade ytor på torra prover. I högvakuum undersöker du oftast metallbelagda prover, medan du studerar obelagda prover i lågvakuum. Typiska prover vi tittar på är bakterier, pollen, vävnadspreparat, insekter och olika sorters material. Med vårt SEM kan du i vissa fall erhålla nanometerupplösning, men exakt hur små detaljer du kan urskilja beror på provets egenskaper.
Provpreparering
För att torka ömtåliga biologiska prover har vi en Leica CPD 300 kritisk punkttork. Med hjälp av vår Cressington 208 auto sputter coater, som är utrustad med ett guldtarget, skapar vi ett några nanometer tunt guldskikt ovanpå proverna för att göra dem elektriskt ledande.
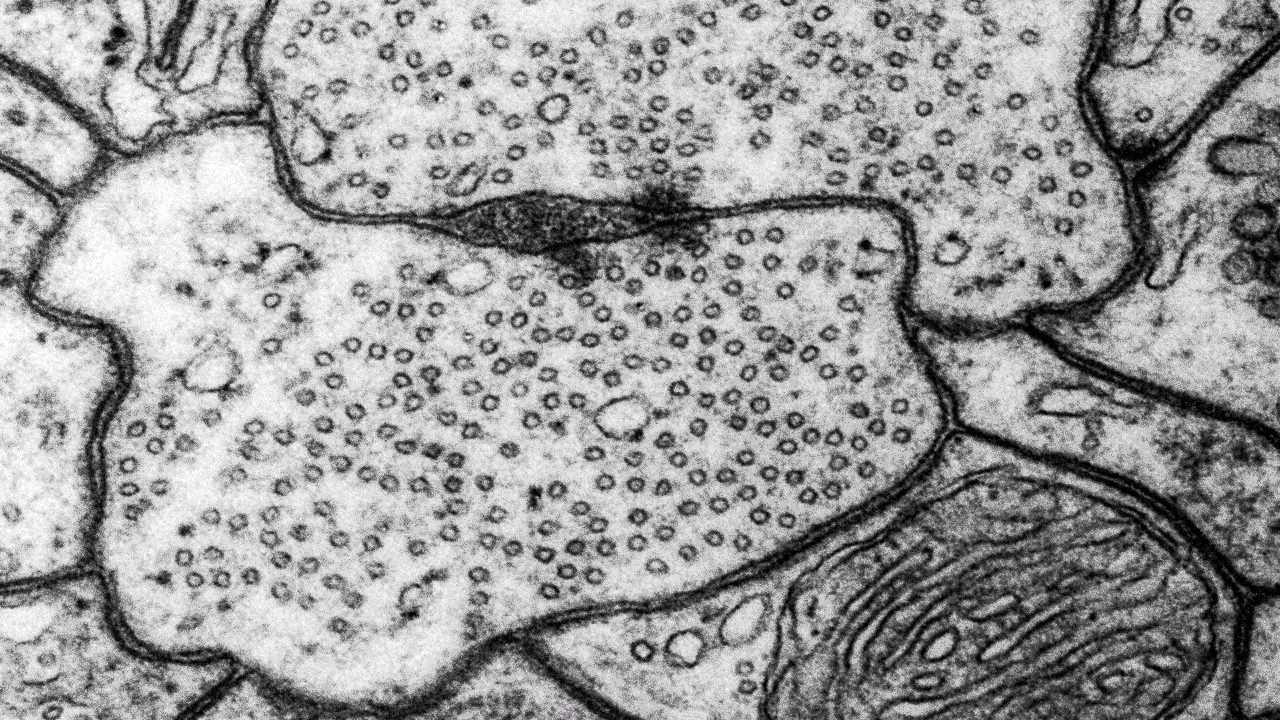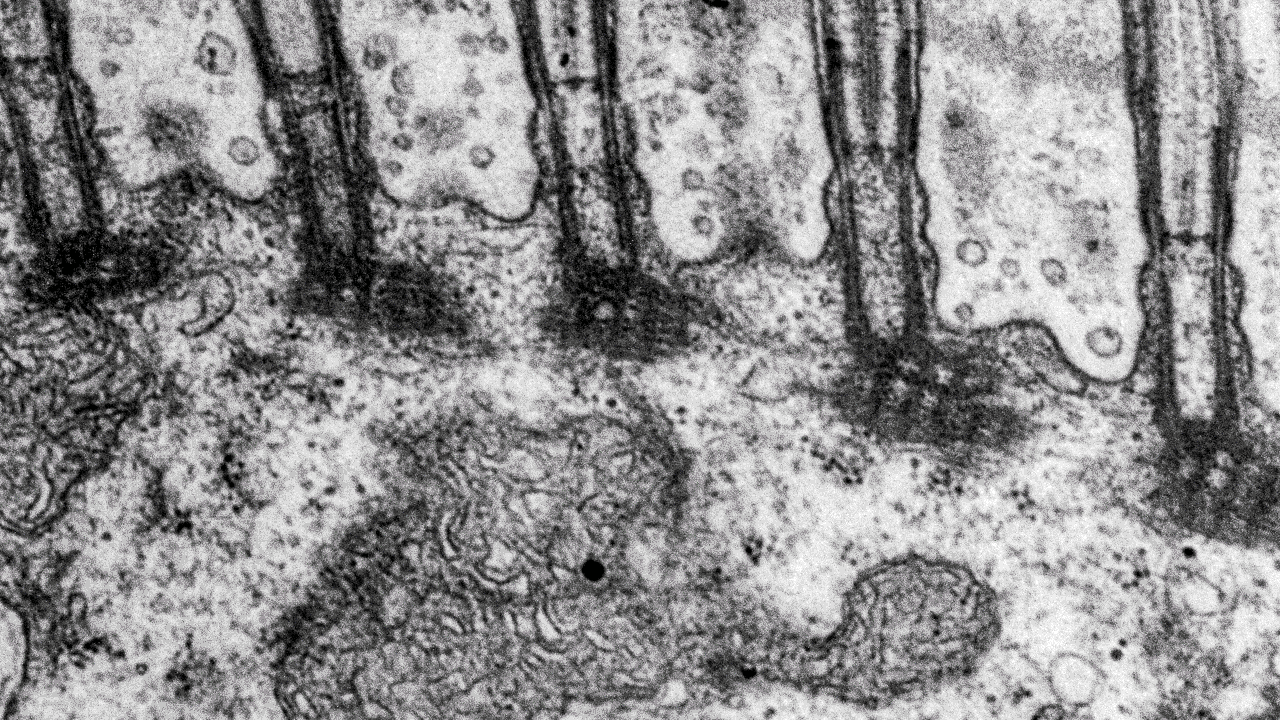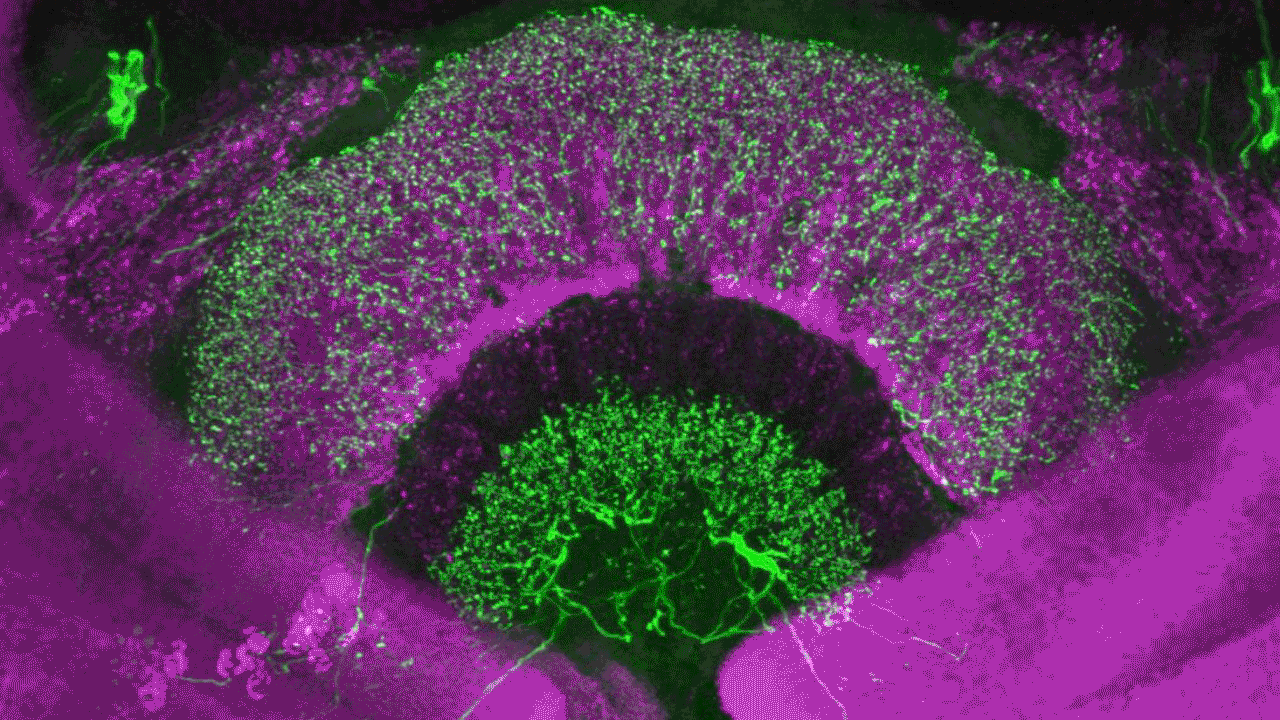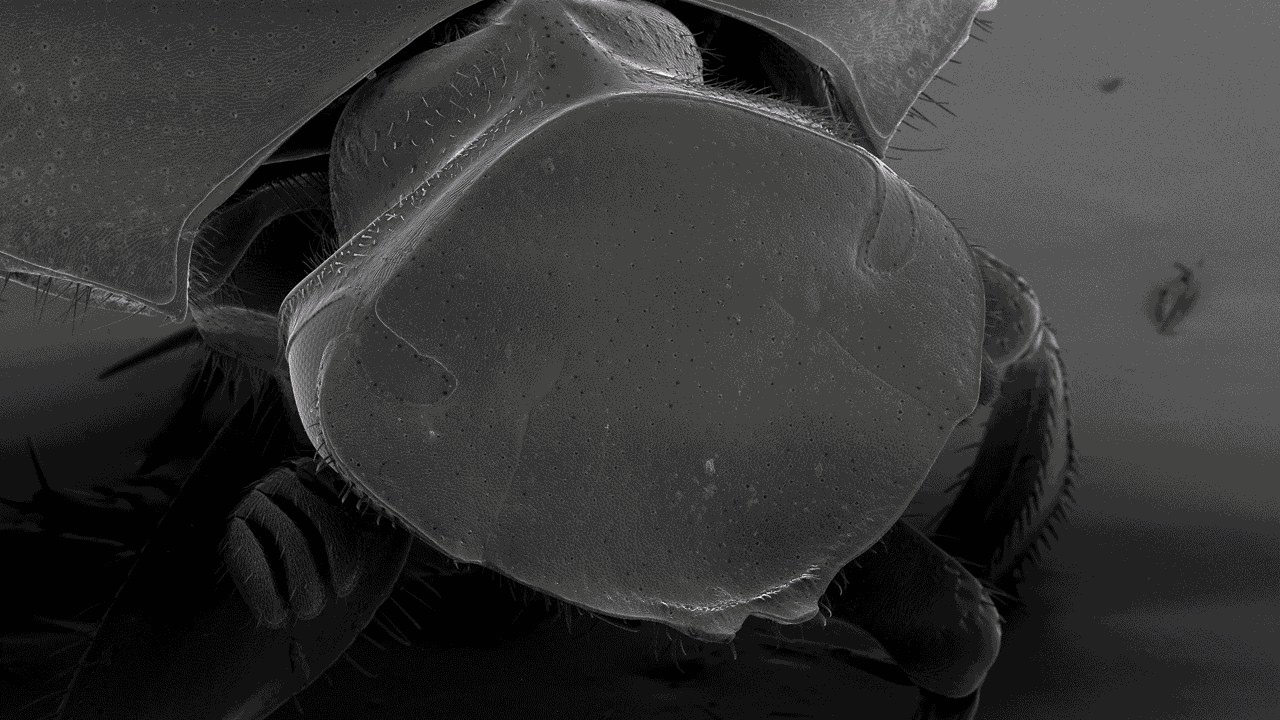
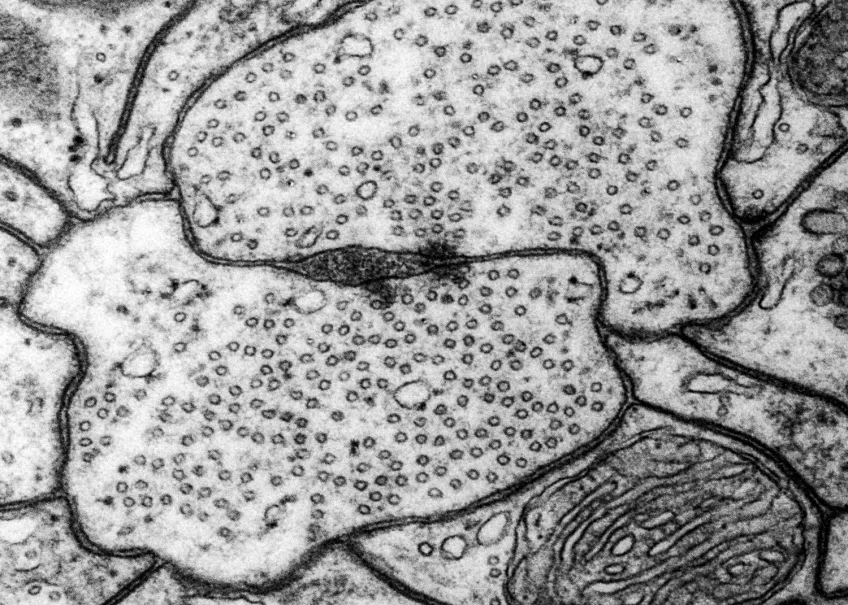
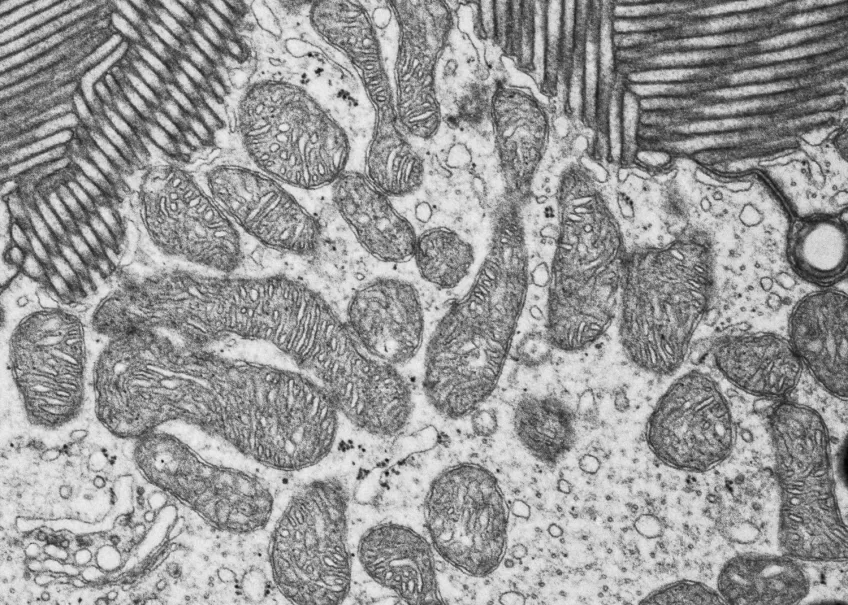
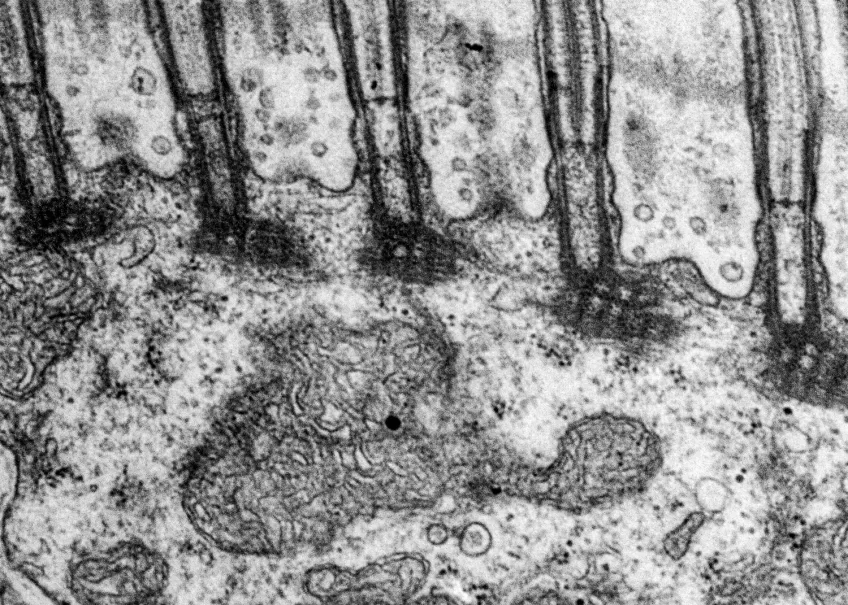
Transmissionselektronmikroskopi (TEM)
Inom många forskningsområden använder man transmissionselektronmikroskop (TEM) för att studera och analysera prover på nanonivå. Med ett transmissionsmikroskop kan du även undersöka strukturer inne i material i detalj.
Vi använder vanligtvis transmissionselektronmikroskop för att titta på ultratunna snitt av celler, vävnader, organeller och till och med virus på subcellulär nivå. Med hjälp av transmissionselektronmikroskopi kan vi också karakterisera nanopartiklar och andra nanomaterial.
Detaljer om vårt transmissionselektronmikroskop
Vårt transmissionselektronmikroskop (TEM) är ett 120 kV JEOL JEM 1400 plus, med en bottenmonterad CMOS-kamera. Mikroskopet har både en enkel- och en pentaprovhållare. Med vårt transmissionselektronmikroskop tittar vi på tunna snitt som är mellan 50 och 70 nm tjocka. Om provet tillåter det kan du studera det i upplösningar på mindre än en nanometer.
Provpreparering för transmissionselektronmikroskopi
I vårt laboratorium får du support under hela processen med att ta fram prov. Vi kan förse dig med de material, kemikalier och utrustning som kan behövas. Vi har en Leica UC7 ultramikrotom utrustad med en diamantkniv för tunnsnittning.

Labbföreståndare
Ola Gustafsson
Fil. Dr., Forskningsingenjör
Telefon: 046 222 93 43
Epost: Ola [dot] Gustafsson [at] biol [dot] lu [dot] se (Ola[dot]Gustafsson[at]biol[dot]lu[dot]se)
Acknowledgement
Om du publicerar en artikel med resultat du fått genom att använda Biologiska institutionens mikroskop ser vi gärna att du låter det framgå genom att skriva:
"We acknowledge the Microscopy Facility at the Department of Biology, Lund University".